Строение ядра.
Автор — профессиональный репетитор, автор учебных пособий для подготовки к ЕГЭ
Игорь Вячеславович Яковлев.
Темы кодификатора ЕГЭ: нуклонная модель ядра, заряд ядра, массовое число ядра.
После опытов Резерфорда, прояснивших устройство атома, возник естественный вопрос: из чего состоит атомное ядро? Ответа пришлось ждать двадцать лет - до открытия нейтрона.
Ядро самого простого атома водорода, как вы помните, было названо протоном. Протон имеет положительный заряд \(e=1,6 \cdot 10^{-19}\) Кл (равный по модулю заряду электрона) и массу \(m_{p}=1,6726 \cdot 10^{-27}\) кг. Масса протона примерно в 1836 раз больше массы электрона.
Нейтрон был открыт в 1932 году английским физиком Джеймсом Чедвиком. Масса нейтрона \(m_{n}=1,6749 \cdot 10^{-27}\) кг оказалась очень близка к массе протона. Однако, в отличие от протона, нейтрон не имеет электрического заряда.
Открытие нейтрона послужило ключом к пониманию устройства атомного ядра.
Нуклонная модель ядра.
Сразу после открытия нейтрона несколько физиков одновременно высказали идею протонно-нейтронной, или нуклонной , модели ядра. Согласно этой модели ядро состоит из протонов и нейтронов. Будучи "кирпичиками", из которых строится ядро, протоны и нейтроны получили общее название нуклонов. (От лат. nucleus - ядро.)
Модель атомного ядра показана на рис. 1. Красным цветом условно изображены протоны, чёрным - нейтроны.
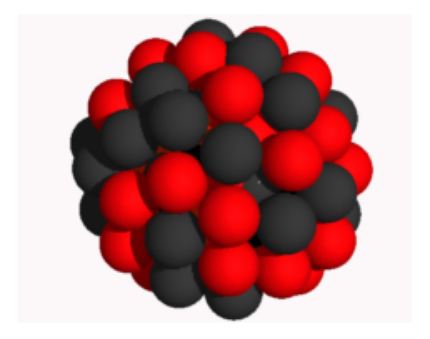 |
| Рис. 1. Модель ядра атома |
Число протонов в ядре называется зарядовым числом и обозначается Z. Заряд ядра, следовательно, равен Ze. Поскольку атом в целом электрически нейтрален, величина Z совпадает с числом электронов в атоме. Зарядовое число, таким образом, есть не что иное, как порядковый номер химического элемента в таблице Менделеева.
Общее число нуклонов в ядре называется массовым числом и обозначается A. Число нейтронов в ядре тогда будет равно A-Z.
Запись \(_{Z}^{A}\textrm{X} \) означает, что в ядре элемента X содержится A нуклонов, из которых Z являются протонами. Например, ядро алюминия \(_{13}^{27}\textrm{Al} \) состоит из 27 нуклонов, а именно из 13 протонов и 14 нейтронов. Ядро гелия \(_{2}^{4}\textrm{He} \) - так называемая \(\alpha \)-частица - состоит из двух протонов и двух нейтронов.
Изотопы.
Что будет, если изменить число нейтронов ядре? Какие-то свойства вещества в результате должны поменяться - например, плотность. Однако все химические свойства при этом останутся прежними - ведь за них отвечает зарядовое число Z, а оно-то не менялось!
Изотопы - это разновидности одного и того же химического элемента, различающиеся числом нейтронов в ядре.
Например, у водорода три изотопа: обычный \(_{1}^{1}\textrm{H} \), дейтерий \(_{1}^{2}\textrm{H} \) и тритий \(_{1}^{3}\textrm{H} \). А химический элемент уран имеет 26 изотопов! В природе наиболее распространён уран \(_{92}^{238}\textrm{U} \), а в атомной энергетике и ядерном оружии используется уран \(_{92}^{235}\textrm{U} \).
Изотопы совершенно идентичны в отношении химических свойств, и их невозможно разделить никакими химическими методами. Оказывается, почти любой элемент таблицы Менделеева представляет собой смесь изотопов в различных пропорциях - вот почему атомные массы химических элементов не равны целым числам. Как правило, атомная масса всё же достаточно близка к целому числу, поскольку в природе доминирует изотоп именно с такой атомной массой (например, в природном уране доля изотопа \(_{92}^{238}\textrm{U} \) составляет 93%; соответственно, в таблице Менделеева мы видим атомную массу урана, равную 238,03). Но бывают и исключения: так, атомная масса хлора равна 35,5.
Изотопы могут различаться также своими радиоактивными свойствами: у одного и того же химического элемента могут быть как стабильные изотопы, так и подверженные радиоактивному распаду (например, углерод \(_{6}^{12}\textrm{C} \) стабилен, а изотоп \(_{6}^{14}\textrm{C} \) - радиоактивен). Собственно, именно это наблюдение - что вроде бы одно и то же вещество бывает то радиоактивным, то нет - и навело в своё время на мысль о существовании изотопов. Радиоактивность будет темой следующей темы.



























