Повторим основные классы неорганических соединений.
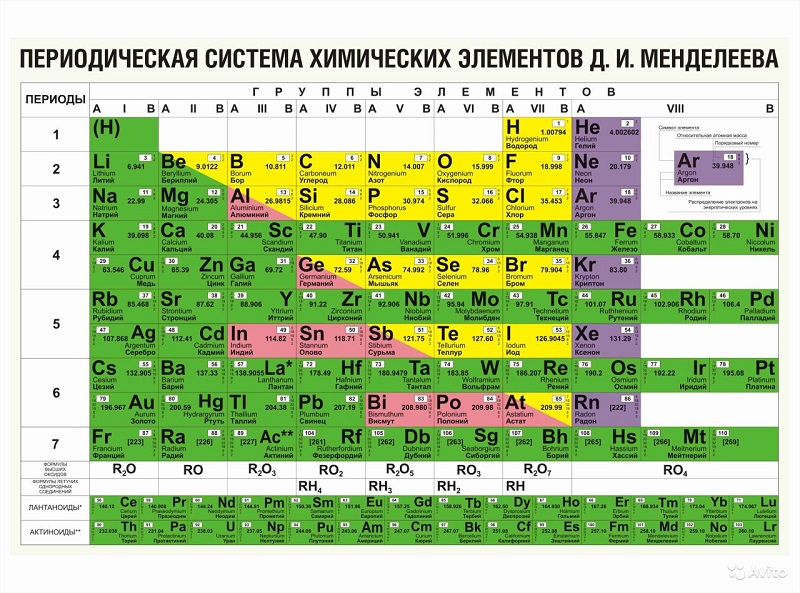
- Простые вещества. Вещества, состоящие из атомов одного типа. К ним относятся:
- Металлы (Me). Металлы характеризуются рядом физических свойств. Это электропроводность, ковкость и металлический блеск. К металлам относят элементы главных подгрупп, находящиеся на диагонали от \(\rm Be\) к \(\rm Po\) и находящиеся левее этой диагонали. Металлами являются также все элементы побочных групп. В приложенной таблице Менделеева металлы окрашены в зеленый, розовый цвет или двумя цветами сразу. Среди металлов отдельно выделяют:
− щелочные. Металлы I А группы. \(\rm Li, Na, K, Rb, Cs\);
− щелочноземельные. \(\rm Ca, Sr, Ba\).
- Неметаллы (НеМе). В приложенной таблице неметаллы окрашены в желтый и фиолетовый цвета. Среди неметаллов отдельно выделяют:
− галогены. Неметаллы VII A группы. \(\rm F_2, Cl_2, Br_2, I_2\);
− благородные газы. \(\rm He, Ne, Ar, Xe, Rn\).
- Оксиды. Соединения, содержащие только элемент и кислород в степени окисления \(-2\). Внимание, оксидами не являются перекиси \(\rm Na_2O_2, H_2O_2, BaO_2\) и фторид кислорода \(\rm O^{+2}F_2\).
- Основные оксиды. Оксиды, которым соответствуют основные гидроксиды. Это оксиды металлов в степени окисления \(+1\) и \(+2\), кроме \(\rm ZnO\) и \(\rm BeO\). Например, основными являются \(\rm CuO, K_2O, MgO, FeO,\)\(\rm BaO, Li_2O\).
- Амфотерные оксиды. Оксиды, которым соответствует амфотерные гидроксиды. Это оксиды металлов в степенях окисления \(+3\) и \(+4\), а также \(\rm ZnO\) и \(\rm BeO\). Например, амфотерными оксидами являются \(\rm Fe_2O_3, Al_2O_3,\)\(\rm TiO_2, BeO, Cr_2O_3\).
- Несолеобразующие оксиды. Несолеобразующие оксиды не реагируют с кислотами и щелочами, иногда их называют безразличными оксидами. В школьном курсе встречаются три несолеобразующих оксида: \(\rm CO, NO, N_2O\).
- Кислотные оксиды. Оксиды, которым соответствуют кислотные гидроксиды. Кислотными считаются все оксиды неметаллов, кроме несолеобразующих, и оксиды металлов со степенями окисления \(+5\), \(+6\), \(+7\). Например, кислотными оксидами являются \(\rm SO_2, N_2O_5, SO_3, SiO_2, CrO_3, Mn_2O_7\).
- Гидроксиды. В состав гидроксидов входят атомы водорода, кислорода и еще некоего элемента. В зависимости от характера гидроксидов, их изображают либо как \(\rm R(OH)_n\) или как \(\rm H_xRO_y\).
- Основные гидроксиды или основания. Это соединения вида \(\rm Me(OH)_n\), проявляющие определенный набор свойств (основных свойств). Основаниями являются гидроксиды металлов в степенях окисления \(+1\) и \(+2\), кроме \(\rm Zn(OH)_2\) и \(\rm Be(OH)_2\). Например, основаниями являются \(\rm Mg(OH)_2, KOH, Ba(OH)_2, Cu(OH)_2, LiOH.\)
- Амфотерные гидроксиды. Гидроксиды, проявляющие свойства оснований и кислот. Амфотерными являются гидроксиды вида \(\rm Me(OH)_n\), где степень окисления металла \(+3\) или \(+2\) (в случае \(\rm Be\) и \(\rm Zn\)). Например, амфотерными гидроксидами являются \(\rm Al(OH)_3, Fe(OH)_3, Zn(OH)_2, Be(OH)_2, Cr(OH)_3\).
- Кислотные гидроксиды или кислородосодержащие кислоты. Имеют общий вид \(\rm H_xRO_y\), где \(\rm R\) – неметалл или металл в степени окисления \(+5, +6, +7.\) Примерами кислородосодержащих кислот могут быть \(\rm HNO_3, H_2SO_4, HMnO_4, H_2CrO_4, H_2SiO_3.\) Стоит заметить, что кислоты бывают и бескислородными, но они не являются гидроксидами. Бескислородные кислоты: \(\rm HCl, HBr, HI, H_2S, HF.\)
- Соли.Сложные соединения, содержащие в своем составе металлы (или металлоподобный ион \(\rm NH_4^+\)) и кислотные остатки. Кислотным остатком \(\rm (K.O.)\) называется кислота, лишившаяся атомов \(\rm H.\)
- Средние. \(\rm Me_x(K.O.)_y\) Соли, содержащие только металл (или металлоподобный ион \(\rm NH_4^+\)) и кислотный остаток. Примеры таких солей: \(\rm K_3PO_4, NH_4Cl, Ba(NO_3)_2, Cr_2(SO_4)_3.\)
- Кислые. \(\rm MeH(K.O.)\) Кислые соли отличаются от средних наличием в составе атомов \(\rm H,\) оставшихся от кислоты. Примеры таких солей: \(\rm KH_2PO_4, NaHSO_4, Ca(H_2PO_4)_2, NH_4HSO_4.\) Кислыми солями не являются средние соли аммония: \(\rm NH_4NO_3, NH_4Cl\) и подобные.
- Основные соли. \(\rm Me(OH)(K.O.)\) Основные соли, в отличие от средних, имеют группу \(\rm OH\), пришедшую из основания. Примеры основных солей: \(\rm Cu_2(OH)_2CO_3, Fe(OH)Cl_2, Ba(OH)Br\).
- Двойные. \(\rm Me_1Me_2(K.O.)\) Соли, содержащие два металла и один кислотный остаток. Примеры двойных солей: \(\rm NH_4MgPO_4, KAl(SO_4)_2, KNaCO_3.\)
- Смешанные. \(\rm Me(K.O.)_1(K.O.)_2\) Соли, содержащие один металл и два кислотных остатка. Пример смешанной соли: \(\rm Ca(OCl)Cl.\)
- Комплексные соли. \(\rm \ldots[Me(L)_n] \ldots \) Более сложный вид солей, содержащий в центре атом металла (комплексообразующий ион), а рядом с металлом в скобках указывают лиганд. В школьном курсе чаще всего попадаются следующие комплексные соли: \(\rm [Cu(NH_3)_4]SO_4, K_3[Fe(CN)_6], K_4[Fe(CN)_6], K_3[Al(OH)_6], Na_2[Zn(OH)_4]\) и подобные.
















































